Pesquisadores decifram mecanismo que determina a complexidade do receptor de glicocorticóide
Crédito: Pesquisa de ácidos nucléicos (2025). DOI: 10.1093/nar/gkaf1003
Decifrar como o GR forma oligômeros – através da ligação de várias subunidades – abre um caminho crucial para o desenvolvimento de medicamentos mais seletivos. Esses novos medicamentos poderiam modular essa associação e, assim, minimizar efeitos adversos graves, como imunossupressão ou perda óssea.
O estudo foi liderado pela pesquisadora Eva Estébanez-Perpiñá, professora Serra Húnter do Departamento de Bioquímica e Biomedicina Molecular da Faculdade de Biologia e do Instituto de Biomedicina (IBUB) da Universidade de Barcelona, com sede no Parque Científico de Barcelona (PCB). Os jovens pesquisadores Andrea Alegre-Martí e Alba Jiménez-Paniño (IBUB) são os primeiros coautores do artigo.
O estudo publicado em Pesquisa de ácidos nucléicosé o resultado de uma extensa colaboração nacional e internacional que reuniu equipas lideradas por Gordon L. Hager, dos Institutos Nacionais de Saúde dos EUA (NIH), e Jaime Rubio e M. Núria Peralta, da Faculdade de Química da UB e do Instituto de Química Teórica e Computacional (IQTCUB).
A equipe também incluiu membros do núcleo de Espectrometria de Massa e Proteômica do Instituto de Pesquisa em Biomedicina (IRB Barcelona), do Centro de Pesquisa em Ciências Relacionadas à Vinha e ao Vinho (ICVV-CSIC), ao Instituto de Biomedicina de Valência (IBV-CSIC) e à Universidade de Buenos Aires (Argentina).
Uma proteína flexível com múltiplas conformações
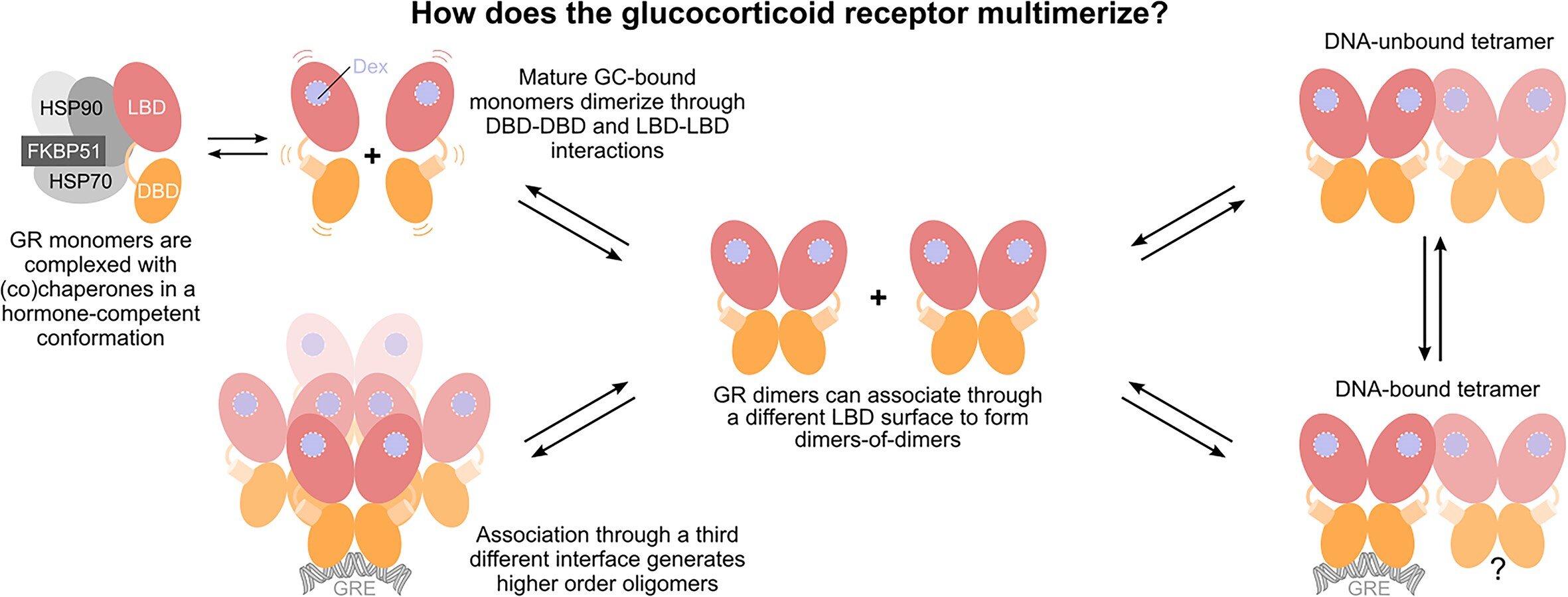
Durante décadas, a comunidade científica considerou que o GR atuava apenas como monômero ou como homodímero (isto é, uma ou duas cópias do receptor). Este estudo rompe com o modelo tradicional e revela, pela primeira vez, que dentro do núcleo da célula o receptor forma oligômeros maiores, compostos principalmente por quatro subunidades (tetrâmeros).
“O receptor de glicocorticóide controla aproximadamente 20% do transcriptoma humano e é fundamental na regulação da glicemia, do metabolismo e da resposta antiinflamatória”, explica a professora Eva Estébanez-Perpiñá.
“Esta é, de facto, a primeira vez que apresentamos à comunidade científica um mecanismo coerente para explicar como o GR se associa ao núcleo celular. Estes resultados reafirmam a importância de mais pesquisas para determinar experimentalmente as estruturas tridimensionais das proteínas e seus complexos.
A formação desses complexos ocorre graças às interações identificadas pela equipe, específicas do domínio de ligação ao ligante do GR. Em um Estudo de 2022 a equipe identificou 20 formas diferentes de associação entre as subunidades, o novo estudo vai além e define quais formas oligoméricas são mais relevantes para a função fisiológica do GR.
“A conformação ativa do GR é claramente diferente do modelo tradicional descrito para outros receptores nucleares”, afirma o pesquisador e autor Pablo Fuentes-Prior (IBUB). “Conforme publicamos em 2022, a unidade funcional é um homodímero não canônico que se associa através das primeiras hélices do domínio de ligação ao ligante. Isso confirma que o GR funciona de maneira diferente de seus homólogos.”
O novo estudo confirma que este dímero básico é essencial para a função transcricional do receptor “e, além disso, funciona como uma espécie de bloco de construção num LEGO molecular para formar estruturas mais complexas”. “Essas estruturas, principalmente tetrâmeros, são as que realmente representam a forma ativa do GR quando se liga ao DNA”, observam Alegre-Martí e Jiménez-Panizo.
A conformação ativa do GR demonstra alta plasticidade em sua superfície de interação dimérica. Esta flexibilidade permite-lhe adoptar uma gama de estruturas mais abertas ou mais fechadas. “Essa oscilação entre as diferentes conformações é essencial para garantir o correto funcionamento da maquinaria transcricional coordenada pelo GR”, diz Fuentes-Prior.
O GR, como um “contorcionista molecular”, é extremamente flexível, capaz de adotar múltiplas conformações e associar-se a diversas proteínas nucleares. Em particular, esta complexidade tornou difícil a sua caracterização estrutural e, até agora, apenas estruturas isoladas dos seus domínios de ligação ao DNA e ao ligante foram resolvidas.
Para superar este desafio, o estudo combinou um conjunto de técnicas de ponta da biologia estrutural e molecular, incluindo cristalografia de raios X utilizando radiação síncrotron ALBA, simulações de dinâmica molecular, espectrometria de massa, microscopia de fluorescência de alta resolução (número e brilho) e RNA celular.
“Essa estratégia combinada foi essencial para superar as dificuldades inerentes ao estudo de uma proteína estruturalmente tão complexa”, afirma a equipe. “Graças a isso, conseguimos propor um mecanismo molecular detalhado e coerente para as interações que impulsionam a multimerização dos receptores de glicocorticóides.”
Mutações que afetam o receptor de glicocorticóide
Mutações no gene GR podem alterar diretamente o processo de multimerização, levando a formas aberrantes e perda da funcionalidade da proteína. É o que acontece na síndrome de Chrousos, uma doença rara caracterizada por resistência aos glicocorticóides e graves distúrbios imunológicos, metabólicos e de crescimento.
O estudo contribui para o conhecimento dos mecanismos moleculares da doença causada por essas mutações e apresenta um catálogo abrangente de variantes patológicas, localizadas principalmente na superfície do domínio de ligação ao ligante. Em contraste com as mutações na bolsa de ligação hormonal – cuja patogenicidade já era conhecida – este artigo explica pela primeira vez o efeito das mutações nos resíduos superficiais do domínio associado à resistência aos glicocorticóides, sem uma explicação clara até o momento. Algumas dessas mutações enfraquecem o dímero e interferem na sua formação. Na maioria das vezes, as mutações aumentam a hidrofobicidade da superfície do receptor, forçando a formação de estruturas maiores (hexâmeros e octâmeros) com atividade transcricional reduzida.
“Além das doenças autoimunes e inflamatórias, estas descobertas abrem novos caminhos para abordar doenças associadas à disfunção do GR, incluindo a asma, a síndrome de Cushing e a doença de Addison. Em última análise, a nossa investigação estabelece as bases para a concepção de medicamentos de precisão capazes de modular a função do GR com especificidade sem precedentes”, conclui a equipa de investigação.
Mais informações:
Andrea Alegre-Martí et al, A via de multimerização do receptor de glicocorticóide, Pesquisa de ácidos nucléicos (2025). DOI: 10.1093/nar/gkaf1003
Citação: Pesquisadores decifram um mecanismo que determina a complexidade do receptor de glicocorticóide (2025, 27 de outubro) recuperado em 27 de outubro de 2025 em
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Share this content:

Publicar comentário