Molécula de RNA recentemente descoberta pode limitar a agregação de proteínas e prevenir danos neuronais
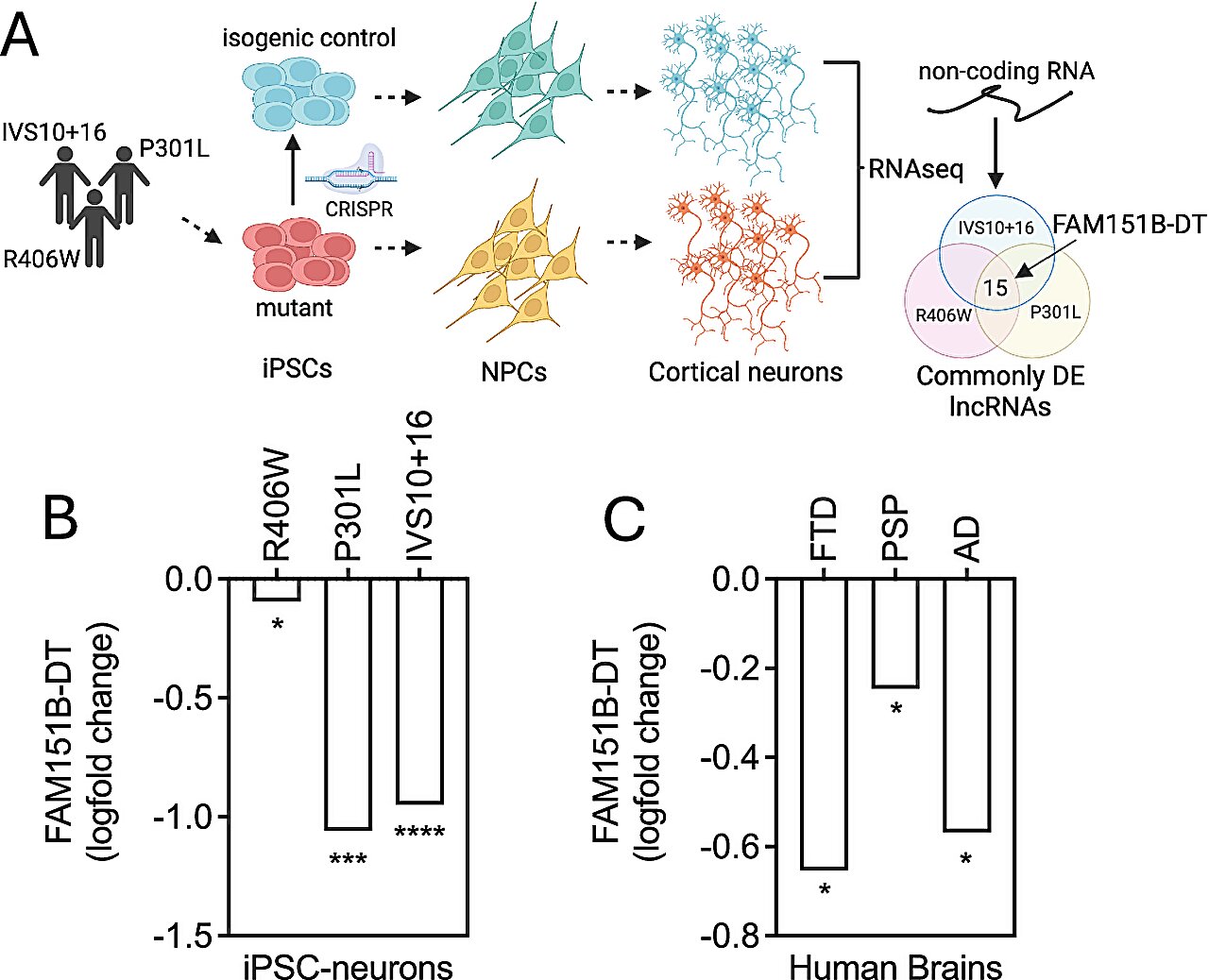
A expressão de FAM151B-DT é significativamente reduzida em neurônios mutantes MAPT e cérebros de tauopatia. Crédito: Psiquiatria Molecular (2025). DOI: 10.1038/s41380-025-03277-6
As doenças neurodegenerativas, como a doença de Alzheimer e a demência, são condições médicas que implicam a perda progressiva de neurónios e um declínio da função cerebral. Estudos anteriores encontraram uma ligação entre estas doenças e a acumulação de proteínas mal dobradas, como a tau e a α-sinucleína.
Tau é uma proteína encontrada principalmente nos neurônios que normalmente ajuda a estabilizar estruturas que transportam nutrientes e moléculas dentro dos neurônios, conhecidas como microtúbulos. A α-sinucleína, por outro lado, é uma pequena proteína localizada nas pontas dos neurônios (isto é, pré-sinapses), que normalmente ajuda a regular a função das vesículas sinápticas, pequenos sacos que liberam neurotransmissores através das sinapses.
Embora estas proteínas tenham uma função importante no cérebro saudável, descobriu-se que a sua agregação anormal é uma marca registrada de várias doenças neurodegenerativas. Os processos moleculares que levam à sua acumulação, no entanto, ainda não foram totalmente elucidados.
Pesquisadores da Universidade de Washington em St. Louis e da Universidade da Califórnia investigaram recentemente o papel de uma molécula de RNA recém-descoberta, chamada FAM151B-DT, na agregação de proteínas tau e α-sinucleína. Suas descobertas, publicado em Psiquiatria Molecularsugerem que este RNA é um regulador chave da homeostase proteica, ou seja, que ajuda a manter o equilíbrio na produção e degradação de proteínas no cérebro.
“As doenças neurodegenerativas partilham características comuns de agregação de proteínas juntamente com outras características pleiotrópicas, incluindo mudanças nos padrões transcricionais, neuroinflamação, perturbação na sinalização sináptica, disfunção mitocondrial, stress oxidativo e mecanismos de depuração deficientes como a autofagia”, escreveram Arun Renganathan, Miguel A. Minaya e os seus colegas no seu artigo.
“No entanto, os principais reguladores dessas características pleiotrópicas ainda não foram identificados. Usamos transcriptômica, espectrometria de massa e ensaios bioquímicos para definir o papel de um novo lncRNA na fisiopatologia da tau.”
Um RNA anteriormente desconhecido implicado na agregação de proteínas
Como parte do estudo, Renganathan e seus colegas examinaram células-tronco e amostras de tecidos usando uma ampla gama de ferramentas genéticas e experimentais. Especificamente, eles compararam os níveis da proteína lncRNA em tecidos cerebrais derivados de indivíduos que foram diagnosticados com uma doença neurodegenerativa com os de pessoas que não o foram.
“Descobrimos um longo RNA não codificante (lncRNA), FAM151B-DT, que é reduzido em um modelo de células-tronco de demência lobar frontotemporal com inclusões de tau (FTLD-tau) e em cérebros de FTLD-tau, paralisia supranuclear progressiva, doença de Alzheimer e pacientes com doença de Parkinson”, escreveram Renganathan e seus colegas. “Mostramos que silenciar FAM151B-DT in vitro é suficiente para aumentar a agregação de tau e α-sinucleína.”
Os pesquisadores cultivaram células-tronco em laboratório e depois silenciaram a proteína que identificaram nessas células. Notavelmente, descobriram que isto aumentou a agregação de proteínas associadas a várias doenças neurodegenerativas.
“Para começar a entender o mecanismo pelo qual o FAM151B-DT medeia a agregação da tau e contribui para várias doenças neurodegenerativas, caracterizamos profundamente este novo lncRNA e descobrimos que o FAM151B-DT reside no citoplasma onde interage com a tau, α-sinucleína”, escreveram os autores. “HSC70 e outras proteínas envolvidas na homeostase proteica. Quando silenciado, o FAM151B-DT bloqueia a autofagia, levando ao acúmulo de tau e α-sinucleína.”
Informando o tratamento de doenças neurodegenerativas
No geral, os resultados deste estudo recente sugerem que a molécula de RNA FAM151B-DT é de fundamental importância para o equilíbrio das proteínas tau e α-sinucleína nas células. O silenciamento desta molécula parece provocar a agregação indesejável de proteínas ligadas ao dano neuronal e ao surgimento de doenças neurodegenerativas.
A visão recolhida por Renganathan e seus colegas poderia melhorar a compreensão actual de várias doenças neurodegenerativas. No futuro, a molécula que identificaram poderá revelar-se um alvo promissor para o tratamento precoce destas doenças ou para a resolução de alguns dos seus sintomas.
“É importante ressaltar que descobrimos que o aumento da expressão de FAM151B-DT é suficiente para promover a depuração autofágica de tau e α-sinucleína fosforiladas e reduzir a agregação de tau e α-sinucleína”, escreveram os autores. “No geral, estas descobertas abrem caminho para uma maior exploração do FAM151B-DT como um alvo molecular promissor para várias doenças neurodegenerativas”.
Escrito para você pelo nosso autor Ingrid Fadellieditado por Gaby Clarke verificados e revisados por Robert Egan—este artigo é o resultado de um cuidadoso trabalho humano. Contamos com leitores como você para manter vivo o jornalismo científico independente. Se este relatório for importante para você, considere um doação (especialmente mensalmente). Você receberá um sem anúncios conta como um agradecimento.
Mais informações:
Arun Renganathan et al, um novo LNCRNA FAM151B-DT Regulas Degradação de proteínas de agregação, Psiquiatria Molecular (2025). DOI: 10.1038/s41380-025-03277-6.
© 2025 Science X Network
Citação: Molécula de RNA recém-descoberta pode limitar a agregação de proteínas e prevenir danos neuronais (2025, 12 de novembro) recuperado em 12 de novembro de 2025 em
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Share this content:


Publicar comentário