Células cancerosas deficientes em MTAP compartilham sinais que silenciam a imunidade
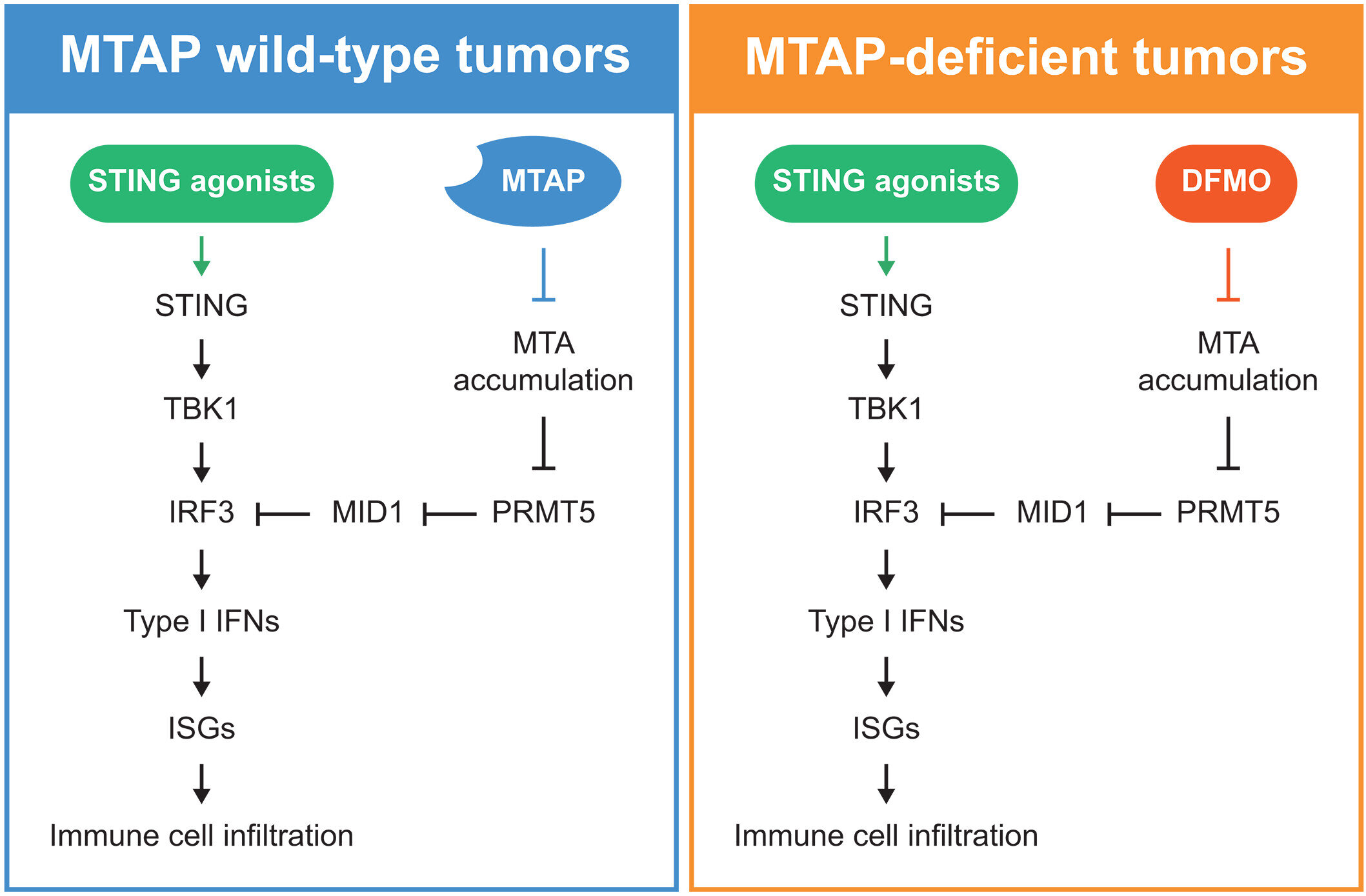
Regulação dependente de MTAP da via STING e estratégia terapêutica com agonistas STING. Crédito: Ciência (2025). DOI: 10.1126/science.adl4089
A China Medical University lidera uma equipe multi-institucional que relata que a deficiência de MTAP suprime a detecção de ácidos nucleicos citosólicos e impulsiona a resistência aos agonistas STING, com um medicamento existente, DFMO, restaurando a atividade da via e as respostas antitumorais.
MTAP codifica a metiltioadenosina fosforilase, uma enzima na via de resgate da metionina que recicla metiltioadenosina em metionina. O gene reside no cromossomo 9p21.3, adjacente aos genes supressores de tumor CDKN2A e CDKN2B, e é frequentemente codecluído com eles em diversos cânceres humanos. A perda de MTAP tem sido associada a alterações no metabolismo celular e a mudanças nas vias de metilação, mas seus efeitos mais amplos na sinalização imunológica permanecem sob investigação.
A difluorometilornitina (DFMO) foi originalmente desenvolvida na década de 1970 para tratar infecções parasitárias. Embora tenha visto uma série de aplicações desde então, estudos pré-clínicos mostraram que o DFMO reduz as concentrações de poliamina e retarda a proliferação de células tumorais em modelos animais de câncer de cólon, mama e próstata. O perfil de segurança favorável do DFMO e seu mecanismo de inibição da via da poliamina levaram à sua exploração em outros tipos de tumores e estratégias combinadas de imunoterapia.
As vias de detecção de ácido nucleico citosólico são alvos para transformar tumores do deserto imunológico em tumores imunoativos, e estudos anteriores em animais com agonistas STING mostraram forte atividade antitumoral, enquanto ensaios com pacientes não relataram nenhum benefício óbvio, indicando uma lacuna translacional.
No estudo, “a deficiência de MTAP confere resistência à detecção de ácidos nucleicos citosólicos e aos agonistas STING”, publicado em Ciênciaos pesquisadores desenvolveram uma série de experimentos moleculares e in vivo para determinar como a perda de MTAP altera a sinalização do interferon e se o direcionamento do metabolismo da poliamina com DFMO pode restaurar a atividade da via e as respostas antitumorais.
Os pesquisadores usaram pares de linhas celulares isogênicas de câncer humano diferindo apenas no status MTAP, microarranjos de tecidos de 430 amostras de tumor para correlação MTAP-IRF3 e modelos bilaterais de camundongos singênicos usando tumores EMT6 e MC38 em camundongos BALB/c e C57BL/6.
A perda de MTAP silenciou um alarme de perigo central dentro das células cancerígenas. Através dos pares isogênicos, as células sem MTAP apresentaram rajadas fracas de IFNβ e genes estimulados por interferon após poli (dA: dT), poli (I: C) ou 2′, 3′-cGAMP. A adição adicional de MTAP ou IRF3 restaurou esses sinais. Os tumores humanos mostraram a mesma relação. Microarranjos de tecidos de 430 amostras ligaram MTAP mais alto com proteína IRF3 mais alta por imuno-histoquímica.
O trabalho mecanicista traçou uma cadeia desde o metabolismo até a sinalização imunológica. A perda de MTAP produziu um acúmulo de metiltioadenosina que inibiu o PRMT5, reduziu a proteína IRF3 e entorpeceu a detecção de ácido nucleico citosólico. Experimentos em meio condicionado e tratamento direto com metiltioadenosina estenderam esse freio ao câncer e às células imunológicas intactas do MTAP vizinhos, reduzindo a atividade do PRMT5 e do IRF3 nesses vizinhos.
Os estudos de transcrição e proteína convergiram para a degradação regulada em vez da perda transcricional. O RNA-seq não mostrou uma queda consistente no mRNA do IRF3, enquanto o MID1 aumentou com nocaute de MTAP, knockdown de PRMT5 ou inibição de PRMT5. O bloqueio do proteassoma restaurou o IRF3 em células deficientes em MTAP. Derrubar o MID1 restaurou o IRF3. Forçar a expressão MID1 empurrou o IRF3 para baixo nas células intactas do MTAP.
O DFMO reverteu o gargalo metabólico e reviveu a detecção. O tratamento reduziu a metiltioadenosina, restaurou a atividade do PRMT5, reduziu o MID1 e resgatou o IRF3 juntamente com os genes estimulados por IFNβ e interferon em células deficientes em MTAP e nulas em MTAP.
Os estudos com ratos refletiram os dados das células. Tumores sem MTAP resistiram aos agonistas de STING. O emparelhamento do DFMO com um agonista STING reduziu os tumores nos flancos injetados e distantes e melhorou a sobrevida nos modelos EMT6 e MC38, com aumento de CD4+ Células T, CD8+ Células T, células dendríticas e células B dentro de tumores.
Pesquisas do genoma do câncer mapearam o cenário clínico. A inativação do MTAP apareceu em cerca de 11% dos tumores, a inativação do STING em cerca de 27% e ambas juntas em cerca de 2%, apontando para grupos amplamente separados.
Os autores concluem que o status do MTAP pode orientar a triagem dos pacientes para imunoterapia baseada em STING e que o DFMO pode aumentar a eficácia clínica dos agonistas do STING em tumores com eliminação de MTAP.
Escrito para você pelo nosso autor Justin Jacksoneditado por Gaby Clarke verificados e revisados por Robert Egan—este artigo é o resultado de um cuidadoso trabalho humano. Contamos com leitores como você para manter vivo o jornalismo científico independente. Se este relatório for importante para você, considere um doação (especialmente mensalmente). Você receberá um sem anúncios conta como um agradecimento.
Mais informações:
Jung-Mao Hsu et al, a deficiência de MTAP confere resistência à detecção de ácido nucleico citosólico e agonistas STING, Ciência (2025). DOI: 10.1126/science.adl4089
© 2025 Science X Network
Citação: Células cancerosas deficientes em MTAP compartilham sinais que silenciam a imunidade (2025, 22 de outubro) recuperado em 22 de outubro de 2025 em
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Share this content:


Publicar comentário