A reprogramação epigenética modifica com segurança vários genes em células T simultaneamente para terapias CAR-T
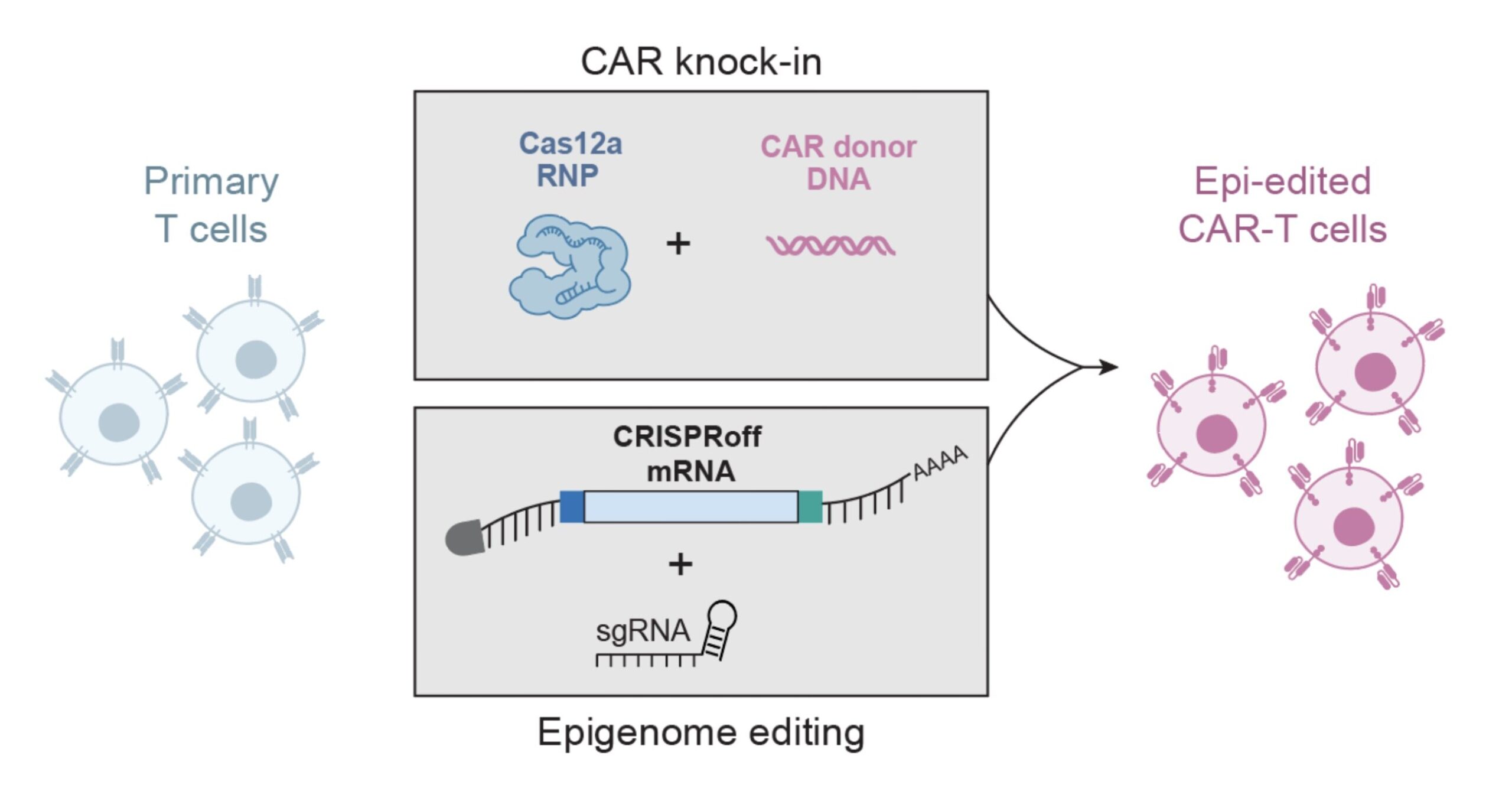
Células T primárias modificadas usando duas abordagens. Os receptores CAR são introduzidos através da inserção direcionada de DNA (parte superior), enquanto o mRNA CRISPRoff e os RNAs guia silenciam genes adicionais por meio de modificações epigenéticas (parte inferior). Isto cria células CAR-T com capacidades aprimoradas sem a toxicidade de cortar o DNA em vários locais. Crédito: Chiara Ricci-Tam
Arc Institute, Gladstone Institutes e University of California, San Francisco, cientistas desenvolveram uma plataforma de edição epigenética que permite a modificação segura de múltiplos genes em células T humanas primárias, abordando um desafio chave de fabricação e escalabilidade em terapias celulares de próxima geração.
A pesquisa, publicada em Biotecnologia da Naturezademonstra como CRISPRoff e CRISPRon podem reprogramar as células T do próprio paciente para fins terapêuticos sem a toxicidade celular e os danos ao DNA associados às abordagens tradicionais de edição de genes.
Um número crescente de terapias com células T, incluindo intervenções CAR-T, são tratamentos personalizados que modificam geneticamente as células T de um paciente para atingir e destruir as células cancerígenas. Estas abordagens têm sido bem sucedidas contra cancros do sangue, mas muitas vezes falham quando aplicadas a tumores sólidos, que criam ambientes hostis que estimulam excessivamente e depois esgotam as células T.
No entanto, usar CRISPR para projetar células T “blindadas” mais complexas que têm energia para operar em tumores sólidos tem se mostrado um desafio devido à toxicidade e à morte celular causada pela edição de vários genes simultaneamente.
CRISPRoff e CRISPRon evitam esse problema, permitindo que os cientistas silenciem ou ativem genes de forma programática por meio de modificações epigenéticas – marcadores químicos estáveis que controlam a expressão genética sem cortar o DNA ou alterar a sequência do genoma.
O CRISPRoff silencia genes que normalmente limitam a função das células T, depositando marcas de metilação nos promotores alvo, enquanto o CRISPRon ativa genes benéficos, removendo essas marcas.
Ao contrário das abordagens tradicionais do CRISPR, que exigem o corte da hélice do DNA, que pode danificar ou matar as células T, esses editores epigenéticos podem modificar até cinco genes simultaneamente, mantendo altas taxas de sobrevivência celular.
“As células T memorizam essencialmente nossas instruções de programação”, diz Luke Gilbert, investigador principal do Arc Institute e professor associado da UCSF.
“Entregamos os editores epigenéticos por apenas alguns dias, mas os efeitos de silenciamento genético permanecem estáveis através de dezenas de divisões celulares e múltiplas rodadas de ativação imunológica”.
Para demonstrar o potencial da plataforma, os pesquisadores criaram células CAR-T aprimoradas, inserindo receptores direcionados ao câncer usando CRISPR e, simultaneamente, usando CRISPRoff para silenciar o RASA2, um gene que atua como um freio molecular na ativação das células T.
As células de engenharia dupla mantiveram a sua capacidade de matar o cancro através de repetidos desafios em testes laboratoriais, enquanto as células CAR-T sem o silenciamento RASA2 ficaram exaustas. Em modelos de leucemia em ratos, as células CAR-T melhoradas proporcionaram um controle tumoral significativamente melhor e melhoraram a sobrevivência em comparação com as abordagens CAR-T padrão.
“Aqui, usamos a engenharia genética para programar células T para procurar células cancerígenas e usamos a engenharia epigenética para programar a força da sua função anticancerígena”, diz Alex Marson, diretor do Instituto de Imunologia Genômica Gladstone-UCSF e co-autor sênior do estudo.
“Reunir o poder combinado da engenharia genética e epigenética oferece agora amplas esperanças de desenvolver programas distintos para tratar uma ampla gama de doenças diferentes”.
“Em vez de apenas adicionar capacidades de direcionamento, podemos reprogramar sistematicamente como essas células funcionam de maneira escalonável para criar produtos terapêuticos mais eficazes”, diz o primeiro autor Laine Goudy, Ph.D. estudante nos laboratórios Marson e Gilbert. “Os dados deste artigo podem apoiar a passagem direta para ensaios clínicos para determinadas aplicações”.
Além das aplicações no câncer, a abordagem abre novas possibilidades para tratamentos de doenças autoimunes, medicina de transplante e outras áreas onde as células T reprogramadas poderiam trazer benefícios aos pacientes.
CRISPRoff trabalha com protocolos de fabricação de células já usados para produzir tratamentos CAR-T aprovados pela FDA, exigindo apenas a conversão de reagentes de nível de pesquisa em versões de nível clínico. A equipe de pesquisa está considerando os próximos passos para testar a tecnologia em humanos.
“Quando começamos, não tínhamos certeza de que isso teria sucesso nas células T, e foram necessários anos de otimização metódica para superar alguns desafios fundamentais, mas foi muito gratificante ver que a tecnologia central é extremamente robusta”, diz Gilbert. “As terapias CAR-T são uma incrível história de sucesso, mas no contexto dos tumores sólidos, acreditamos que a nossa abordagem poderá impulsionar a próxima geração de abordagens CAR-T para beneficiar os pacientes”.
Gilbert é um dos quatro co-autores seniores do artigo, junto com Brian Shy, professor assistente no Departamento de Medicina Laboratorial da UCSF e Diretor do Programa de Terapia Celular Investigacional da UCSF, Justin Eyquem, professor associado do Departamento de Microbiologia e Imunologia da UCSF, e Marson, que também é investigador sênior em Gladstone e professor na UCSF.
Goudy liderou o desenvolvimento técnico.
Mais informações:
Programação epigenética e genética integrada de células T humanas primárias, Biotecnologia da Natureza (2025). DOI: 10.1038/s41587-025-02856-w.
Citação: A reprogramação epigenética modifica com segurança vários genes em células T simultaneamente para terapias CAR-T (2025, 21 de outubro) recuperado em 21 de outubro de 2025 em
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Share this content:

Publicar comentário