Cientistas encontram um ponto fraco em um fungo mortal que fechou unidades de terapia intensiva de hospitais
Os cientistas identificaram um mecanismo genético que pode apontar para novas formas de tratar uma infecção fúngica rara, mas mortal, que forçou o encerramento de várias unidades de cuidados intensivos hospitalares. A descoberta oferece uma esperança precoce contra um patógeno que tem sido difícil de controlar e quase impossível de tratar depois de se espalhar.
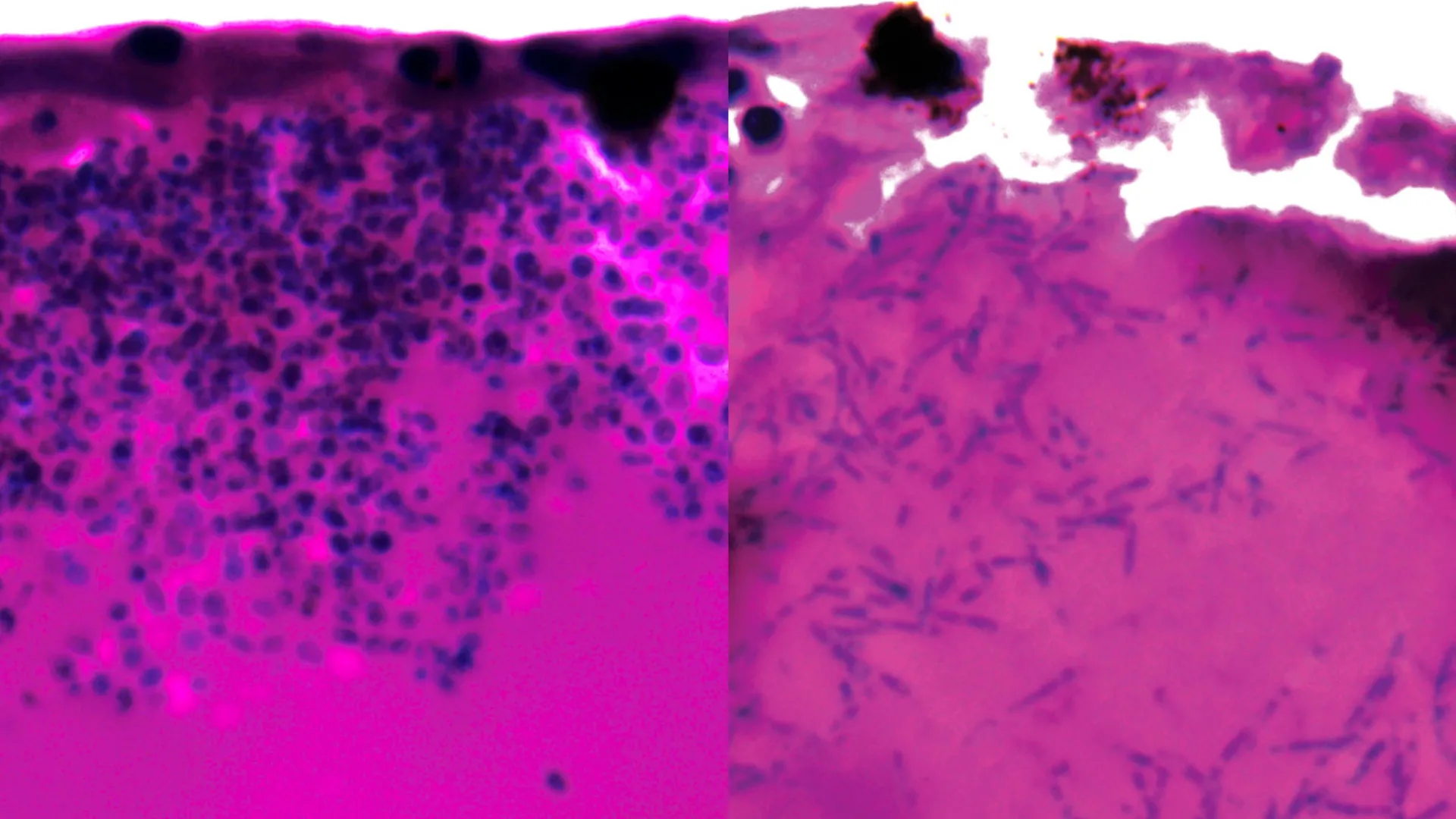
Candida auris é especialmente perigoso para pessoas que já estão gravemente doentes, deixando os hospitais altamente expostos a surtos. Embora o fungo possa existir na pele sem causar sintomas, os pacientes que dependem de ventiladores enfrentam um risco muito maior. Assim que ocorre a infecção, cerca de 45% dos pacientes morrem e o fungo torna-se resistente a todos os principais tipos de medicamentos antifúngicos. Esta resistência torna o tratamento extremamente desafiador e permite que o patógeno persista nas enfermarias do hospital.
Uma ameaça global à saúde com origens misteriosas
A infecção foi detectada pela primeira vez em 2008 e sua origem ainda é desconhecida. Desde então, foram relatados surtos em mais de 40 países, incluindo o Reino Unido. Candida auristambém chamado Candidozyma aurisé agora reconhecido como uma grave ameaça à saúde global e aparece na lista de patógenos fúngicos de prioridade crítica da Organização Mundial da Saúde. No Reino Unido, os casos notificados continuaram a aumentar de forma constante.
Estudando infecção em um modelo vivo
Pesquisadores da Universidade de Exeter deram agora um grande passo ao examinar como os genes são ativados durante Candida auris infecção. Isto marca a primeira vez que tal atividade genética foi estudada num hospedeiro vivo utilizando uma abordagem baseada em larvas de peixes. O estudo foi publicado no periódico Communications Biology da Nature e foi apoiado pela Wellcome, pelo Medical Research Council (MRC) e pelo National Center for Replacement, Reduction and Refinement (NC3Rs).
Os pesquisadores afirmam que os resultados podem ajudar a identificar um alvo biológico para novos tratamentos antifúngicos ou até mesmo permitir a reutilização de medicamentos existentes, caso o mesmo comportamento genético seja confirmado durante a infecção em humanos.
O projeto foi co-liderado pelo professor clínico do NIHR, Hugh Gifford, do Centro MRC de Micologia Médica (CMM) da Universidade de Exeter. Ele disse: “Desde que surgiu, Candida auris tem causado estragos onde se instala nas unidades de cuidados intensivos dos hospitais. Pode ser mortal para pacientes vulneráveis, e os fundos de saúde gastaram milhões no difícil trabalho de erradicação. Acreditamos que a nossa pesquisa pode ter revelado um calcanhar de Aquiles neste patógeno letal durante a infecção ativa, e precisamos urgentemente de mais pesquisas para explorar se podemos encontrar medicamentos que ataquem e explorem esta fraqueza”.
Por que os modelos de pesquisa tradicionais ficaram aquém
Um dos maiores obstáculos no estudo Candida auris tem sido sua capacidade de sobreviver a altas temperaturas. Quando combinado com a sua tolerância invulgarmente forte ao sal, isto levou alguns investigadores a sugerir que pode ter origem em oceanos tropicais ou em animais marinhos. Essas características também dificultaram o estudo em modelos laboratoriais convencionais.
Para superar isso, a equipe de Exeter desenvolveu um novo modelo de infecção usando killifish árabes. Os ovos desta espécie podem sobreviver a temperaturas semelhantes às do corpo humano, tornando-os adequados para observar infecções em condições que se assemelham a doenças reais.
Atividade genética revela possíveis vulnerabilidades
Durante os experimentos, os pesquisadores observaram que Candida auris pode mudar sua forma formando estruturas fúngicas alongadas conhecidas como filamentos. Essas estruturas podem ajudar o fungo na busca por nutrientes enquanto infecta o hospedeiro.
A equipe também analisou quais genes foram ativados ou desligados durante a infecção para identificar possíveis pontos fracos. Vários dos genes que se tornaram ativos são responsáveis pela produção de bombas de nutrientes que capturam moléculas eliminadoras de ferro e transportam o ferro para as células fúngicas. Como o ferro é essencial para a sobrevivência, este processo pode representar uma vulnerabilidade crítica.
Rhys Farrer, do Centro MRC de Micologia Médica da Universidade de Exeter, disse: “Até agora, não tínhamos ideia de quais genes estão ativos durante a infecção de um hospedeiro vivo. Agora precisamos descobrir se isso também ocorre durante a infecção humana. O fato de termos descoberto que os genes são ativados para eliminar o ferro dá pistas sobre onde Candida auris podem ter origem, como um ambiente marinho pobre em ferro. Também nos dá um alvo potencial para medicamentos novos e já existentes.”
Esperança para tratamentos futuros
Dr. Gifford, que também trabalha como médico residente em cuidados intensivos e medicina respiratória no Royal Devon & Exeter Hospital, enfatizou a importância clínica dos resultados. Ele disse: “Embora ainda haja uma série de etapas de pesquisa a serem realizadas, nossa descoberta pode ser uma perspectiva interessante para tratamento futuro. Temos medicamentos direcionados às atividades de eliminação de ferro. Agora precisamos explorar se eles poderiam ser reaproveitados para parar Candida auris de matar humanos e fechar unidades de terapia intensiva de hospitais.”
O modelo de larvas de killifish árabes foi desenvolvido com o apoio de uma bolsa de projeto NC3Rs como uma alternativa ao uso de modelos de camundongos e peixes-zebra, que são comumente usados para estudar interações entre patógenos e seus hospedeiros. A Dra. Katie Bates, Chefe de Financiamento de Pesquisa do NC3R, disse: “Esta nova publicação demonstra a utilidade do modelo de substituição para estudar Candida auris infecção e permitir insights sem precedentes sobre eventos celulares e moleculares em hospedeiros infectados vivos. Este é um exemplo brilhante de como abordagens alternativas inovadoras podem superar as principais limitações dos estudos tradicionais em animais”.
O artigo é intitulado ‘Expressão do gene do transportador de xenosideróforos e filamentação específica do clado em Candida auris peixe matador (Afânio é diferente) infecção’ e é publicado na revista Nature Portfólio Biologia das Comunicações.
Share this content:


Publicar comentário