Um mecanismo oculto muda o que sabemos sobre a divisão celular
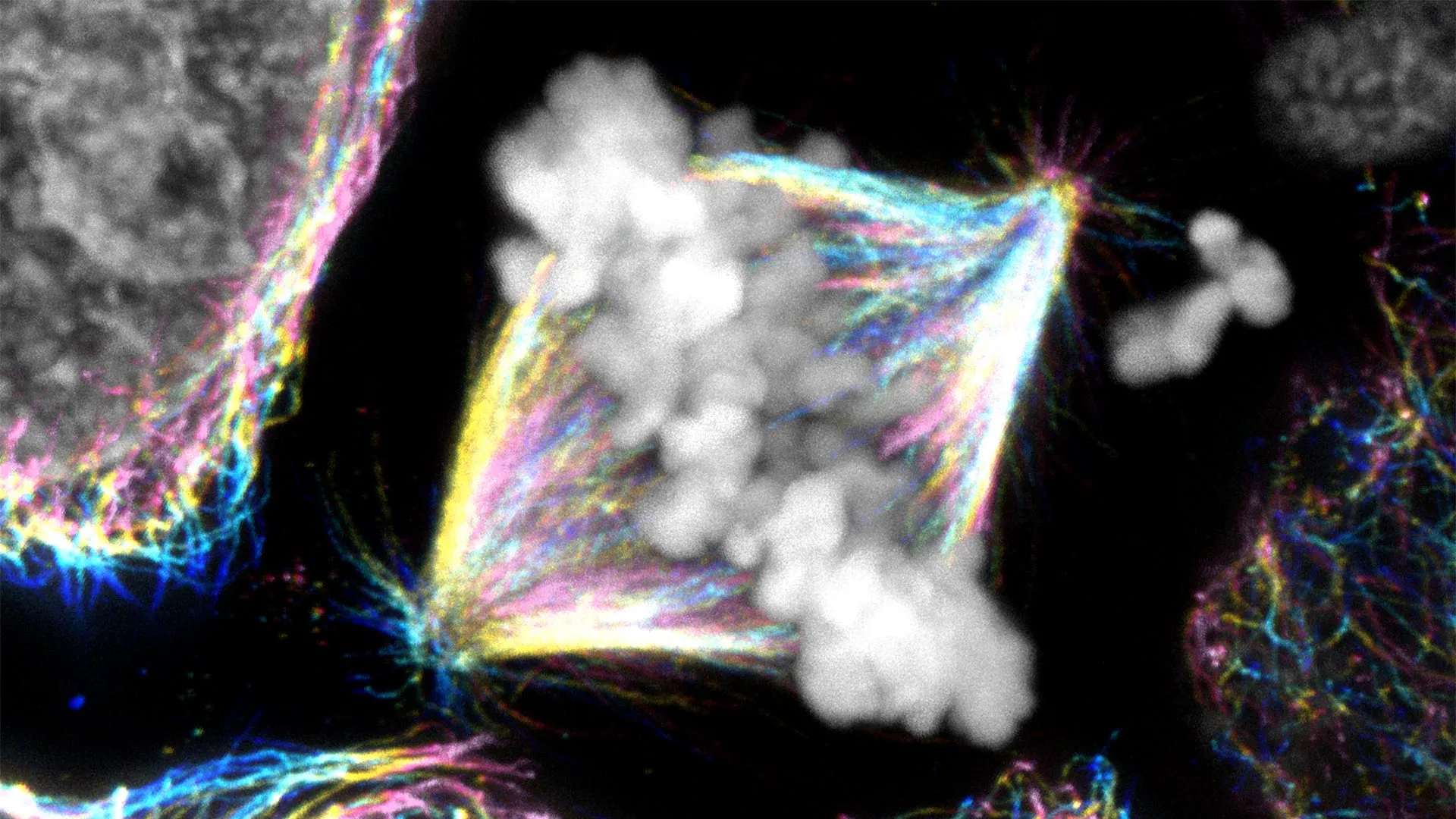
Cientistas do Instituto Ruđer Bošković (RBI) em Zagreb, Croácia, descobriram uma função surpreendente para a proteína CENP-E. Durante anos, pensou-se que agia como um motor que puxava os cromossomos errantes para a posição de uma célula preparada para se dividir. As novas descobertas revelam algo completamente diferente: o CENP-E estabiliza as primeiras conexões entre os cromossomos e as “trilhas” internas da célula, ajudando-as a se alinharem adequadamente antes que a célula se divida.
Um estudo complementar mostrou que os centrômeros, pequenas estruturas nos cromossomos que antes se acreditava que funcionavam por conta própria, desempenham um papel orientador no direcionamento do CENP-E para que possa ajudar o processo de divisão a se desenrolar corretamente. Juntos, estes resultados derrubam duas décadas de ensino aceite e têm implicações importantes, uma vez que erros na ligação cromossómica estão ligados a muitos cancros e doenças genéticas.
Por que o posicionamento precoce do cromossomo é importante
A cada momento, em inúmeras células do corpo, a divisão ocorre com extraordinária precisão. Uma única célula duplica três bilhões de letras de DNA e consegue distribuir cópias perfeitas para ambas as células-filhas.
Quando esse delicado processo falha, as consequências podem ser graves. Mesmo um cromossomo no lugar errado pode atrapalhar o desenvolvimento, contribuir para a infertilidade ou desencadear o câncer. A divisão celular oferece pouco espaço para erros.
Durante muitos anos, os investigadores acreditaram ter compreendido um dos intervenientes centrais: o CENP-E, frequentemente descrito como uma proteína motora que transportava cromossomas perdidos para o meio da célula em divisão. A ideia era simples, amplamente ensinada e, em última análise, incorreta.
Pesquisadores descobrem um papel diferente para o CENP-E
Dois estudos do RBI, publicados na Nature Communications e liderados pelo Dr. Kruno Vukušić e pelo Professor Iva Tolić, quebram o modelo anterior e apresentam uma nova explicação. Vukušić formou-se como investigador de pós-doutoramento numa equipa altamente selectiva do ERC Synergy e está agora a preparar-se para liderar o seu próprio grupo no RBI. O Prof. Tolić, um reconhecido especialista global em biofísica celular e chefe do Laboratório de Biofísica Celular da RBI, possui duas bolsas ERC e é membro da EMBO e da Academia Europaea. O seu trabalho mostra que o CENP-E não é o “músculo” que arrasta os cromossomas para o seu lugar, mas um regulador chave que é ativado no momento certo para permitir que todo o resto se alinhe.
“O CENP-E não é o motor que puxa os cromossomos para o centro”, diz Vukušić. “É o fator que garante que eles possam se conectar corretamente em primeiro lugar. Sem essa estabilização inicial, o sistema para”.
Movimento cromossômico como cidade de trânsito
Imagine uma cidade enorme no pico do tráfego. Milhões de veículos preenchem inúmeros cruzamentos e um único erro pode interromper todo o fluxo.
Agora imagine esta cena reduzida ao interior de uma cela. Os cromossomos agem como trens que transportam carga de DNA, e os microtúbulos formam os trilhos que os guiam. Para que a divisão seja bem-sucedida, cada cromossomo deve se conectar ao conjunto correto de trilhas e mover-se para a posição central.
O modelo de longa data lançou o CENP-E como a locomotiva que puxa os cromossomos atrasados para o lugar. A equipe de Zagreb encontrou uma função mais precisa. Em vez do motor, o CENP-E se comporta como um acoplamento que assegura a ligação entre um cromossomo e o microtúbulo. Quando esse acoplamento é fraco ou ausente, os trens param na periferia da estação e não conseguem avançar.
O que controla quando os cromossomos se movem
Por que alguns cromossomos param nas bordas da célula? A resposta envolve Aurora quinases, um grupo de proteínas que funcionam como semáforos estritos. Eles geram fortes sinais “vermelhos” que impedem que os cromossomos façam ligações iniciais incorretas.
Este sistema protege contra erros perto dos pólos da célula, mas também pode reter os cromossomos de forma muito agressiva. O CENP-E ajuda a restaurar o equilíbrio ajustando esses sinais para que as primeiras conexões adequadas possam ser formadas. Uma vez que essa ligação estável inicial apareça, o alinhamento segue naturalmente através da geometria do fuso e do comportamento dos microtúbulos.
“Não se trata de força bruta”, explica Tolić. “Trata-se de criar as condições para que o sistema funcione sem problemas. O papel fundamental do CENP-E é estabilizar o início e, quando isso acontecer, o resto da mitose se desenrola corretamente.”
Repensando um modelo de livro didático de longa data
Por quase vinte anos, os livros didáticos descreveram o CENP-E como um motor que puxava os cromossomos para a placa metafásica. A nova pesquisa contradiz essa visão.
“O Congresso, o alinhamento dos cromossomos, está intrinsecamente ligado à biorientação”, diz Tolić. “O que mostramos é que o CENP-E não contribui significativamente para o movimento em si. Seu papel crucial é estabilizar as ligações finais no início. É isso que permite que o sistema prossiga corretamente”.
Esta mudança substitui uma explicação baseada na força por uma focada na regulação e no timing. As implicações vão muito além do aprendizado em sala de aula.
Por que esta descoberta é importante para a saúde humana
Para alguém de fora da área, a distinção pode parecer pequena. Na biologia celular, pequenas mudanças muitas vezes revelam verdades importantes. Erros na segregação cromossômica são uma marca registrada do câncer. As células tumorais geralmente apresentam segmentos cromossômicos duplicados ou ausentes, e essas anormalidades geralmente remontam a erros no processo de fixação.
Ao demonstrar que o CENP-E regula as primeiras ligações e ao ligar esta regulação à actividade da Aurora quinase, a equipa de Zagreb ligou dois processos anteriormente considerados como actuando separadamente. Esta ligação expõe um potencial ponto fraco na divisão das células e pode apontar o caminho para terapias que corrijam ou retardem divisões perigosas.
“Não se trata apenas de reescrever um modelo”, diz Vukušić. “Trata-se de identificar um mecanismo que se liga diretamente à doença. Isso abre portas para diagnósticos e para pensar em novas terapias”.
Apoio da Europa e Croácia
A investigação foi possível graças a um financiamento competitivo significativo, incluindo o Synergy Grant do Conselho Europeu de Investigação, a Fundação Croata para a Ciência, projectos bilaterais suíço-croatas e programas de desenvolvimento da UE.
O trabalho também dependeu de recursos computacionais avançados do centro SRCE da Universidade de Zagreb. “A biologia moderna não consiste apenas em microscópios e tubos de ensaio”, diz Tolić. “É também computação e colaboração através de disciplinas e fronteiras.”
Encontrando Estrutura na Complexidade Celular
Em sua essência, a descoberta esclarece como as células mantêm a ordem em meio ao movimento constante. Trilhões de divisões celulares ocorrem diariamente no corpo humano, e cada evento deve lutar contra a atração natural da desordem. O novo entendimento de Zagreb ajuda a revelar uma das estratégias ocultas por trás dessa consistência. Ao reinterpretar o papel do CENP-E e conectá-lo a outros reguladores celulares, a equipe acrescentou clareza a um processo que opera sob imensa pressão.
“Ao descobrir como estes reguladores microscópicos cooperam”, diz Tolić, “não estamos apenas a aprofundar a nossa compreensão da biologia, mas também a aproximar-nos da correção das falhas subjacentes às doenças”.
Share this content:


Publicar comentário