Pesquisadores revelam sistema de controle intrincado para gene imunológico chave
Crédito: Imunidade (2025). DOI: 10.1016/j.immuni.2025.10.020
O sistema imunitário enfrenta um delicado equilíbrio: deve ser suficientemente agressivo para combater infecções e cancro, mas suficientemente contido para evitar atacar os próprios tecidos do corpo.
Há mais de duas décadas, os investigadores identificaram um gene chamado FOXP3 como desempenhando um papel crítico na manutenção deste equilíbrio e na prevenção de doenças autoimunes – trabalho que rendeu o Prémio Nobel de Fisiologia ou Medicina deste ano.
Agora, cientistas dos Institutos Gladstone e da UC San Francisco (UCSF) mapearam a intrincada rede de interruptores genéticos que as células imunológicas usam para ajustar os níveis de FOXP3. Suas descobertas, publicado em Imunidadetêm implicações importantes para o desenvolvimento de terapias imunológicas e abordam um mistério de longa data sobre por que esse gene se comporta de maneira diferente em humanos e em camundongos.
“O FOXP3 é absolutamente essencial para regular o nosso sistema imunológico”, diz Alex Marson, MD, Ph.D., diretor do Instituto de Imunologia Genômica Gladstone-UCSF, que liderou o estudo. “Como é controlado é uma questão fundamental da imunologia, e a resposta detalhada pode oferecer pistas para o desenvolvimento de futuras terapias para doenças autoimunes ou cancro”.
Uma busca por interruptores dimmer
O gene FOXP3 está ativo em todas as células T reguladoras, que mantêm as reações imunológicas sob controle. Sem este gene, as células T reguladoras não podem funcionar adequadamente e o sistema imunológico fica fora de controle, atacando os próprios tecidos do corpo. Pessoas com mutações no FOXP3 desenvolvem doenças autoimunes raras e graves.
Em camundongos, o FOXP3 só é ativado em células T reguladoras. Mas em humanos, as células T convencionais – as células inflamatórias que combatem as infecções – também podem ativar brevemente o FOXP3. Essa diferença intrigou os imunologistas durante anos.
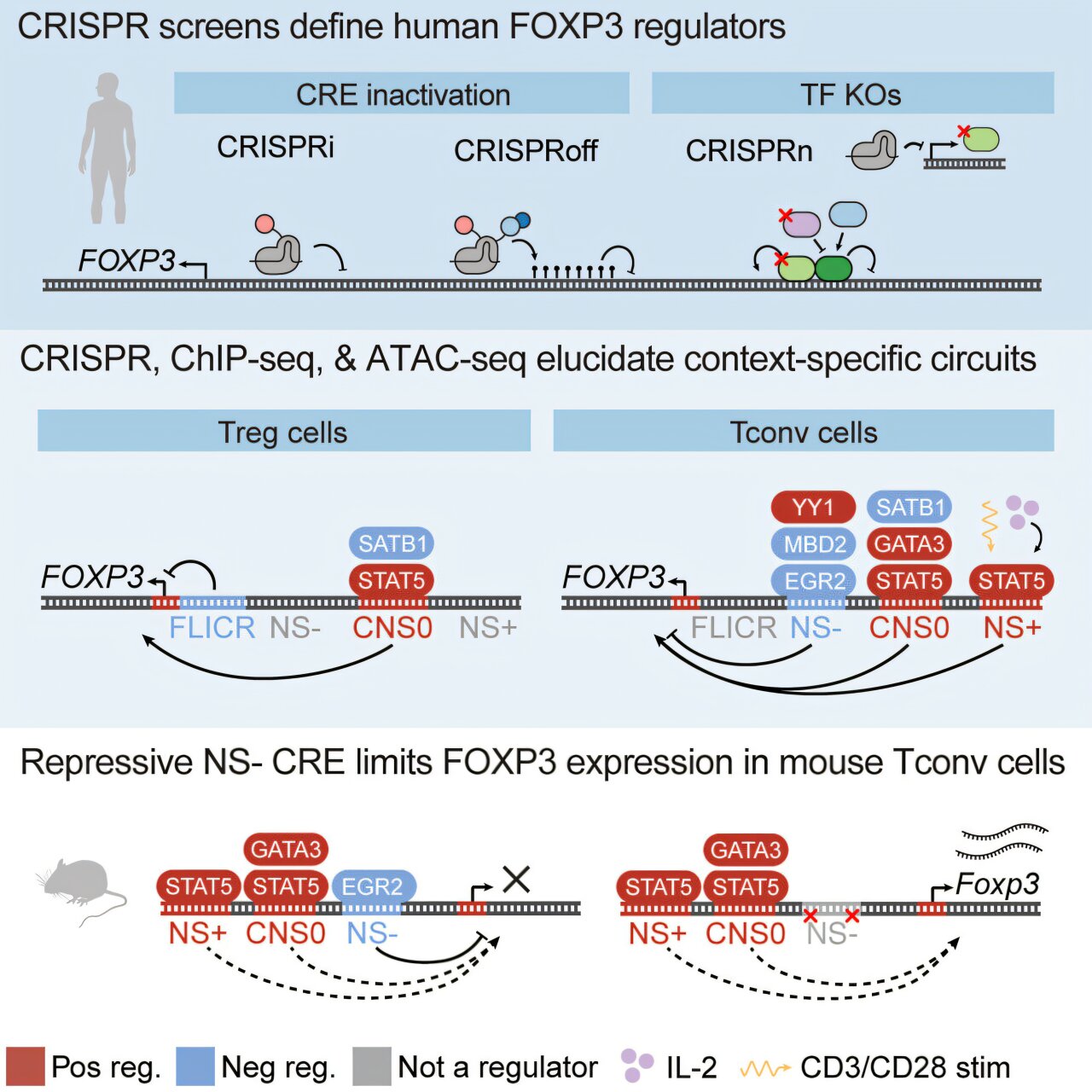
No novo trabalho, o laboratório de Marson usou tecnologia de silenciamento genético baseada em CRISPR para testar sistematicamente 15.000 locais no DNA que cercam o gene FOXP3. Eles procuravam elementos reguladores genéticos – trechos próximos de DNA que agem como interruptores dimmer, controlando quando e quanto um gene é ligado ou desligado.
Ao interromper milhares de locais em células T reguladoras e convencionais de humanos e camundongos e, em seguida, medir os efeitos nos níveis de FOXP3, a equipe identificou quais sequências de DNA próximas controlam o FOXP3.
“Criamos essencialmente um mapa funcional de todo o sistema de controle do FOXP3”, diz Jenny Umhoefer, Ph.D., ex-bolsista de pós-doutorado no laboratório de Marson e primeira autora do novo artigo.

Uma equipe de cientistas – incluindo Jenny Umhoefer, vista aqui – descobre possíveis pistas para futuros tratamentos de autoimunidade e câncer, aprendendo a ajustar um gene que está centralmente envolvido na regulação do sistema imunológico. Crédito: Michael Short / Institutos Gladstone
Painéis de controle imunológico
Os experimentos revelaram que diferentes tipos de células humanas possuem diferentes sistemas de controle para o gene FOXP3. Nas células T reguladoras, onde o FOXP3 deve permanecer constantemente ativo, múltiplos intensificadores – sequências de DNA que aumentam os níveis de um gene – trabalham juntos para garantir que o gene permaneça ativo. Como funcionam de forma redundante, a interrupção de apenas um desses intensificadores teve apenas um pequeno efeito nos níveis de FOXP3.
Nas células T convencionais, apenas dois intensificadores foram mapeados. Mas os pesquisadores também descobriram um repressor inesperado que atua como freio ao gene FOXP3.
“O que estamos vendo é um circuito regulatório sofisticado”, diz Umhoefer. “A célula possui pedais e freios e os coordena para obter um controle preciso.”
Para entender não apenas onde esses interruptores genéticos estão localizados, mas também o que os controla, a equipe conduziu uma segunda tela CRISPR massiva. Desta vez, eles interromperam sistematicamente quase 1.350 genes em todo o genoma para identificar proteínas específicas que controlam os níveis de FOXP3.
Então, trabalhando com o investigador afiliado de Gladstone, Ansuman Satpathy, MD, Ph.D., a equipe usou uma técnica chamada ChIP-seq para mapear fisicamente onde as proteínas estão localizadas no DNA em relação ao gene FOXP3.
“Este foi um grande passo no desenvolvimento de formas de ligar os elementos reguladores locais às proteínas que realmente se ligam a eles”, diz Satpathy, que também é professor associado do Departamento de Patologia da Escola de Medicina de Stanford. “Ninguém havia reunido essas ferramentas de forma tão ampla e sistemática antes.”
Um mistério de espécie
O laboratório de Marson levantou inicialmente a hipótese de que, em humanos, as células T convencionais podem ter um intensificador para ativar o FOXP3 que está faltando nos camundongos, explicando por que as células dos camundongos nunca ativam o gene. Surpreendentemente, eles descobriram que as células T convencionais em camundongos têm todos os mesmos elementos potenciadores que os humanos.
A diferença, perceberam os cientistas, pode estar no repressor que descobriram. Nas células T convencionais de camundongo, esse repressor mantém o FOXP3 constantemente desligado. Quando os pesquisadores usaram o CRISPR para excluir o repressor do DNA dos camundongos, as células T convencionais começaram a expressar o gene FOXP3 como as células humanas.
“Este foi um resultado impressionante”, diz Marson. “Ao remover um único elemento repressivo, poderíamos quebrar a diferença entre espécies e permitir que células T convencionais em camundongos expressem FOXP3. Isso oferece novas dicas sobre como a regulação de genes-chave pode evoluir entre as espécies.”
As descobertas apontam para a importância de estudar a regulação genética nas células humanas e sublinham a necessidade de procurar amplamente os repressores – e não apenas os elementos potenciadores mais comuns.
Engenharia de células de precisão
O novo estudo fornece uma base para esforços contínuos para descobrir e desenvolver novos tratamentos para uma série de doenças. Armados com um mapa completo dos diferentes elementos envolvidos no controle dos níveis do gene FOXP3, os pesquisadores podem começar a desenvolver novas formas de ajustar esses níveis para imunoterapias.
Os tratamentos para doenças autoimunes, por exemplo, podem beneficiar do aumento dos níveis de FOXP3, enquanto os tratamentos para o cancro podem funcionar melhor com uma atividade mais baixa do FOXP3.
“Há enormes esforços neste momento para células T reguladoras de medicamentos, seja para promover a sua atividade ou reduzi-la”, diz Marson. “À medida que entendemos novos aspectos do circuito que distingue as células T reguladoras das células convencionais, podemos pensar em estratégias para manipulá-las racionalmente”.
Mais informações:
Jennifer M. Umhoefer et al, a expressão de FOXP3 depende de elementos reguladores cis específicos do tipo de célula e de circuitos de fatores de transcrição, Imunidade (2025). DOI: 10.1016/j.immuni.2025.10.020
Citação: Pesquisadores revelam sistema de controle intrincado para gene imunológico chave (2025, 13 de novembro) recuperado em 13 de novembro de 2025 em
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Share this content:


1 comentário