Estranhas estruturas microscópicas encontradas no sangue Long COVID
Os pesquisadores também incorporaram ferramentas de Inteligência Artificial, incluindo aprendizado de máquina, para analisar padrões de biomarcadores. Esses métodos permitiram diferenciar com precisão os pacientes com Long COVID de indivíduos saudáveis e identificar as combinações de biomarcadores mais informativas. Tais insights poderiam apoiar diagnósticos mais precisos e futuros tratamentos personalizados.
O que são armadilhas extracelulares de neutrófilos (NETs)?
Alain Thierry e seu grupo do Montpellier Cancer Institute (IRCM) do INSERM em Montpellier foram dos primeiros a destacar a importância dos TNEs na COVID-19. As NETs se formam quando os neutrófilos liberam seu DNA por meio de um processo chamado NETose, criando estruturas semelhantes a fios cheias de enzimas prejudiciais que podem capturar e neutralizar rapidamente os micróbios invasores.
Embora os NETs ajudem na defesa contra infecções, produzir muitos deles pode ser prejudicial. A formação excessiva de NET tem sido associada a condições inflamatórias e de coagulação graves, incluindo infecções graves, doenças autoimunes, câncer, diabetes e artrite. Dr. Thierry observa que a superprodução contínua de TNEs, impulsionada por ciclos de inflamação e formação de coágulos, pode piorar a gravidade da doença.
À luz disto, as equipes lideradas pelo Prof Pretorius e Dr. Thierry trabalharam juntas para examinar se microcoágulos e NETs interagem em pacientes com Long COVID.
Principais descobertas
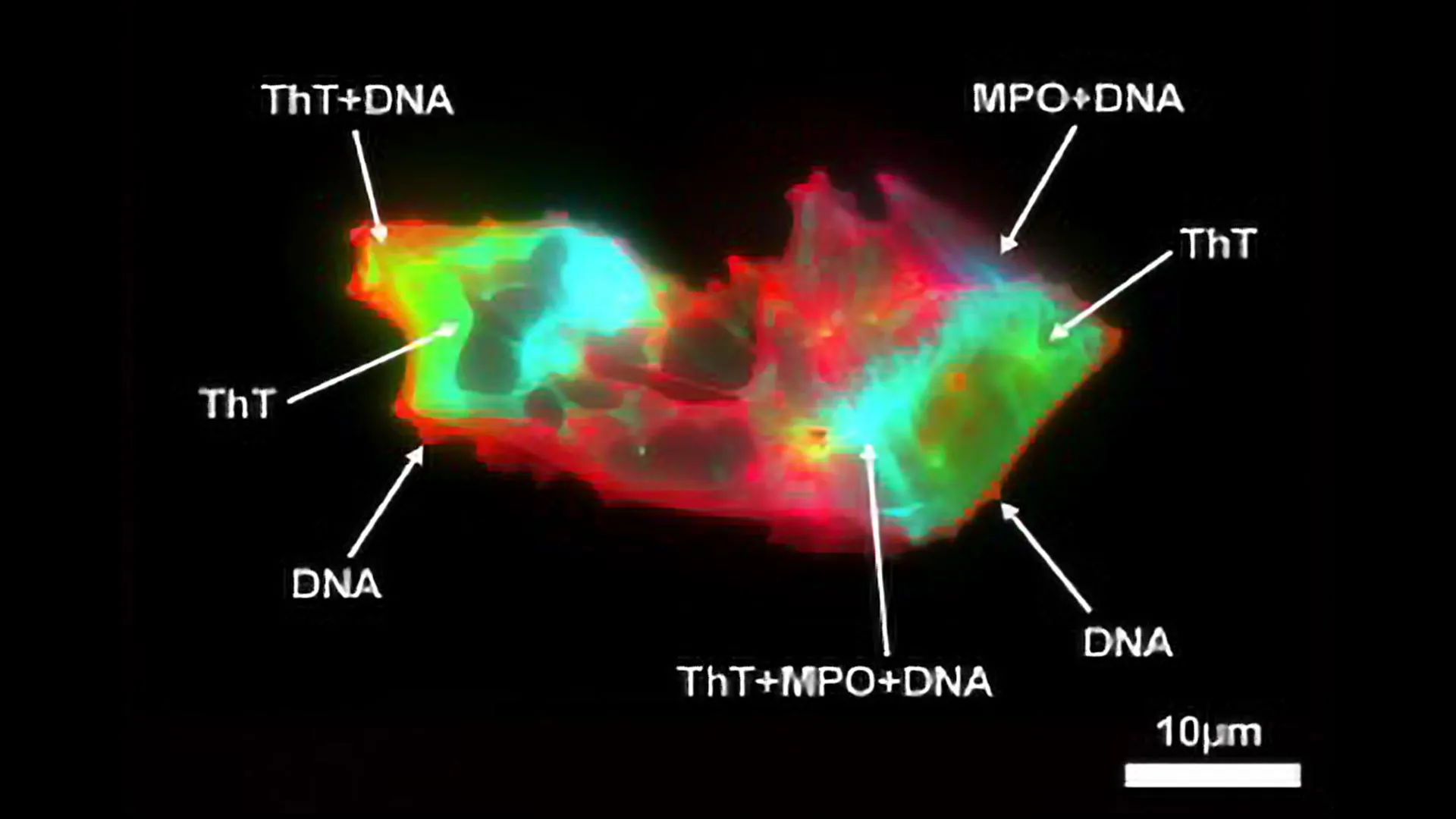
Usando citometria de fluxo de imagem e microscopia de fluorescência, os pesquisadores realizaram medições detalhadas de microcoágulos e NETs no plasma de indivíduos com Long COVID e compararam os resultados com controles saudáveis. Eles também quantificaram NETs avaliando marcadores proteicos e DNA circulante.
Eles relataram várias observações importantes:
- Os biomarcadores ligados a microcoágulos e TNEs foram significativamente elevados em pacientes com COVID longo.
- Os pacientes mostraram não apenas um número aumentado de microcoágulos, mas também microcoágulos maiores.
- Mais notavelmente, a equipe identificou uma relação estrutural entre microcoágulos e NETs. Esta associação apareceu em todas as amostras, mas foi muito mais substancial em pessoas com Long COVID.
“Essa descoberta sugere a existência de interações fisiológicas subjacentes entre microcoágulos e NETs que, quando desreguladas, podem se tornar patogênicas”, explica o Dr. Thierry.
Os pesquisadores também incorporaram ferramentas de Inteligência Artificial, incluindo aprendizado de máquina, para analisar padrões de biomarcadores. Esses métodos permitiram diferenciar com precisão os pacientes com Long COVID de indivíduos saudáveis e identificar as combinações de biomarcadores mais informativas. Tais insights poderiam apoiar diagnósticos mais precisos e futuros tratamentos personalizados.
A professora Pretorius enfatiza que o estudo revela um acúmulo de microcoágulos no plasma de pacientes com Long COVID, provavelmente apoiado pela atividade excessiva do NET: “Essa interação poderia tornar os microcoágulos mais resistentes à fibrinólise, promovendo sua persistência na circulação e contribuindo para complicações microvasculares crônicas”, explica ela.
Ao esclarecer como os NETs podem estabilizar os microcoágulos, o estudo contribui com informações valiosas sobre os processos biológicos envolvidos no Long COVID. As descobertas também destacam potenciais abordagens terapêuticas destinadas a reduzir a coagulação e a inflamação prejudiciais.
Além disso, o trabalho avança na busca por novos biomarcadores que possam auxiliar no diagnóstico e manejo do Long COVID. Como observam os autores, “a combinação de técnicas avançadas de imagem e aprendizado de máquina confere robustez metodológica e contribui significativamente para o discurso científico contínuo sobre síndromes pós-virais”.
Em pacientes com Long COVID, um novo estudo revelou associação estrutural entre microcoágulos circulantes e armadilhas extracelulares de neutrófilos (NETs).
Este achado sugere a existência de interações fisiológicas subjacentes entre microcoágulos e NETS que, quando desreguladas, podem tornar-se patogênicas.
O que são microcoágulos?
O termo microcoágulosrecentemente adotado na literatura científica, refere-se a aglomerados anormais de proteínas de coagulação sanguínea que circulam na corrente sanguínea de um paciente. O conceito foi introduzido em 2021 pela Prof. Resia Pretorius do Departamento de Ciências Fisiológicas da Universidade de Stellenbosch, quando encontraram a presença anormal de tais microcoágulos nas amostras de sangue de pacientes com COVID-19. Esta descoberta gerou ampla atenção durante a pandemia devido ao seu papel potencial nas coagulopatias relacionadas com a COVID.
O que são armadilhas extracelulares de neutrófilos (NETs)?
A equipe do Dr. Alain Thierry do Montpellier Cancer Institute (IRCM) do INSERM em Montpellier foi uma das primeiras a identificar o papel crítico dos NETs na patogênese da COVID-19. Os NETs são produzidos através de uma forma especializada de resposta imune inata conhecida como NETospor meio do qual os neutrófilos expelem seu DNA para formar estruturas filamentosas incorporadas com enzimas citotóxicas capazes de capturar e neutralizar rapidamente patógenos.
No entanto, a formação excessiva de NETs pode tornar-se prejudicial, contribuindo para uma ampla gama de doenças inflamatórias e trombóticas, incluindo infecções graves, doenças autoimunes, cancro, diabetes e artrite.
De acordo com o Dr. Thierry, pode ser que a superprodução persistente de TNEs, alimentada por alças inflamatórias e trombóticas que se autoperpetuam, exacerbe a gravidade da doença.
Num esforço colaborativo, as equipes do Prof. Pretorius e do Dr. Thierry investigaram a interação potencial entre microcoágulos e NETs no contexto de Long COVID.
Principais descobertas
Usando citometria de fluxo de imagem e microscopia de fluorescência, eles realizaram uma análise quantitativa e estrutural de microcoágulos e NETs no plasma de pacientes com Long COVID, em comparação com controles saudáveis. Os NETs também foram quantificados através da análise de marcadores proteicos de NETs e DNA circulante.
- Eles observaram um aumento significativo de biomarcadores associados tanto a microcoágulos quanto a NETs em amostras de pacientes.
- Os microcoágulos não eram apenas mais abundantes, mas também maiores em tamanho entre os pacientes.
- Mais importante ainda, eles descobriram uma associação estrutural não relatada anteriormente entre microcoágulos e TNEs, observada em todos os indivíduos, mas marcadamente mais pronunciada em pacientes com COVID longo.
“Essa descoberta sugere a existência de interações fisiológicas subjacentes entre microcoágulos e NETs que, quando desreguladas, podem se tornar patogênicas”, explica o Dr. Thierry.
Além disso, a integração de ferramentas de Inteligência Artificial, como o aprendizado de máquina, na análise de biomarcadores permitiu distinguir pacientes com COVID Longo de indivíduos saudáveis com alta precisão. Os algoritmos identificaram as combinações de biomarcadores mais preditivas, aumentando a confiabilidade do diagnóstico e abrindo caminho para abordagens de medicina personalizada.
Segundo o professor Pretorius, os resultados revelam um acúmulo significativo de microcoágulos no plasma de pacientes com Long COVID, provavelmente impulsionado e estabilizado pela produção excessiva de NETs: “Essa interação poderia tornar os microcoágulos mais resistentes à fibrinólise, promovendo sua persistência na circulação e contribuindo para complicações microvasculares crônicas”, explica ela.
Ao identificar o papel mecanicista dos NETs na estabilização do microcoágulo, este estudo fornece uma nova visão sobre a fisiopatologia do Long COVID. Estas descobertas apoiam o desenvolvimento de estratégias terapêuticas direcionadas destinadas a modular as respostas trombo-inflamatórias.
Finalmente, o estudo abre caminho para o desenvolvimento de novos biomarcadores para diagnóstico e tratamento: “A combinação de técnicas avançadas de imagem e aprendizagem automática confere robustez metodológica e contribui significativamente para o discurso científico em curso sobre síndromes pós-virais”, concluem.
Share this content:

Publicar comentário