Interações açúcar-proteína, críticas para a placenta durante o início da gravidez, esclarecem complicações comuns
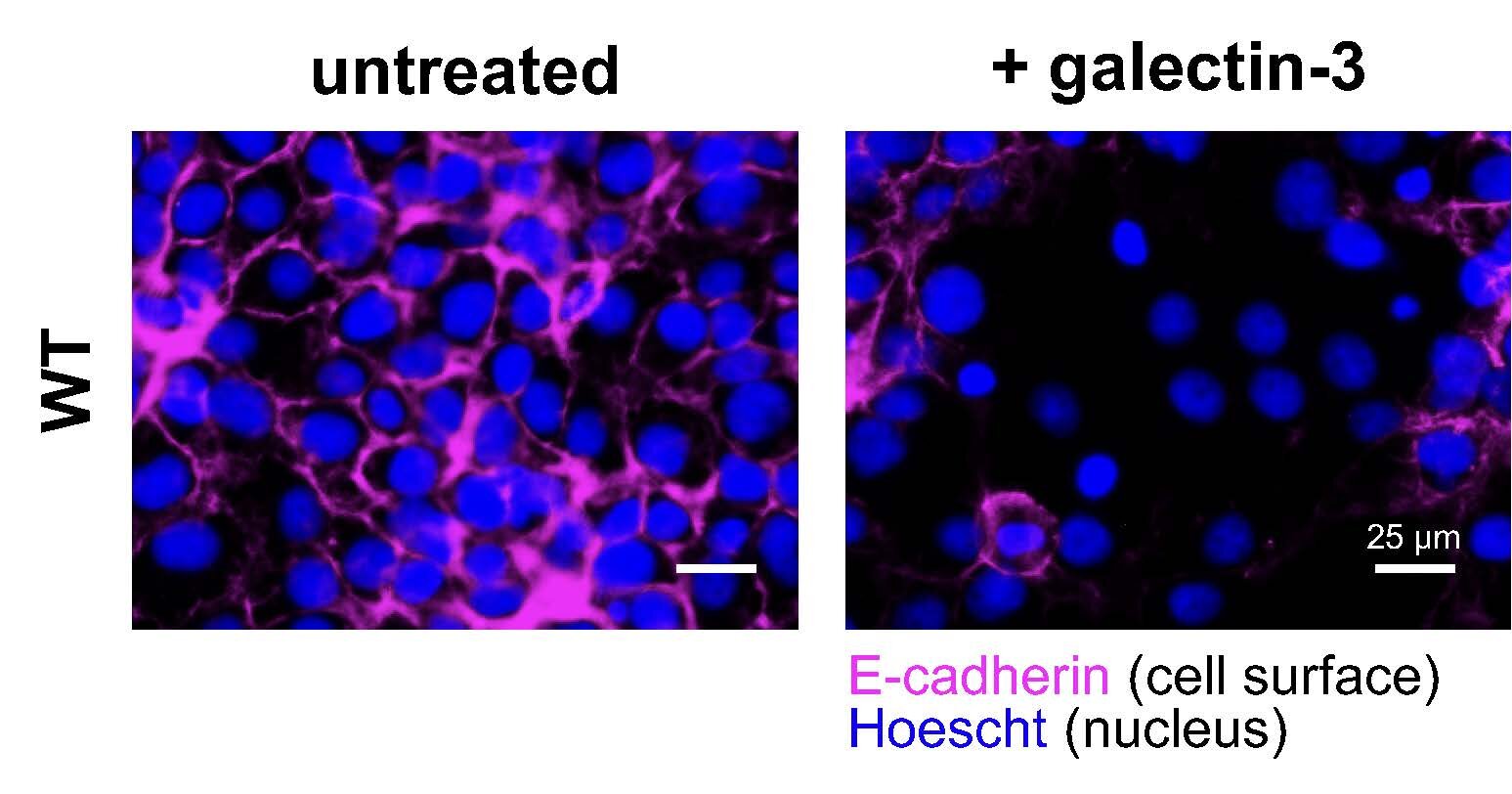
Sem a proteína galectina-3 (esquerda), as células da placenta permanecem separadas, cada uma com seu próprio núcleo (azul) rodeado por um limite celular distinto (rosa). Com a galectina-3 (à direita), as células se fundem em uma grande célula contendo muitos núcleos – uma etapa fundamental na formação da placenta. Crédito: Pesquisa Scripps
Durante as primeiras semanas de gravidez, a placenta em desenvolvimento no útero da mãe sofre uma mudança dramática. As células individuais se fundem, formando uma barreira contínua que passará os próximos nove meses transportando oxigênio e nutrientes para o feto em crescimento, enquanto mantém o sistema imunológico da mãe sob controle. Quando esta estrutura não se forma adequadamente, as gestações correm maior risco de complicações, incluindo pré-eclâmpsia e restrição do crescimento fetal.
Agora, os cientistas da Scripps Research identificaram um elemento-chave na transformação da placenta – uma molécula chamada galectina-3 que se liga a moléculas de açúcar em proteínas específicas da superfície celular, provavelmente mantendo as células da placenta firmemente unidas para se fundirem.
A pesquisa, publicado em Anais da Academia Nacional de Ciênciasnão apenas ilumina um mecanismo importante no desenvolvimento da placenta, mas também demonstra o poder de uma nova técnica para mapear as interações fugazes entre proteínas e açúcares.
“Conseguimos realmente ampliar e mostrar que uma proteína e sua modificação no açúcar são críticas para a biologia da placenta”, diz a autora sênior Mia Huang, professora de química na Scripps Research. “Isso nos dá uma nova visão fundamental sobre a biologia placentária e, eventualmente, pode ter implicações na prevenção ou tratamento de complicações na gravidez”.
A placenta é vital para a gravidez, atuando como local de troca onde o oxigênio e os nutrientes passam da mãe para o feto e os resíduos são removidos. Mas os mecanismos moleculares precisos que constroem este órgão crítico não são claros. Estudos anteriores mostraram correlações entre os níveis de galectina-3 e complicações na gravidez, mas os cientistas não tinham certeza do que exatamente a galectina-3 estava fazendo na placenta.
As proteínas nas superfícies celulares são frequentemente decoradas com cadeias complexas de açúcar – modificações que ajudam as células a se comunicarem e a se reconhecerem. Galectina-3 é conhecida como proteína de ligação ao glicano, o que significa que reconhece e se liga especificamente a certos padrões dessas cadeias de açúcar.
O laboratório de Huang recorreu a uma técnica que usou pela primeira vez em 2020 para mapear quais proteínas decoradas com açúcar a galectina-3 reconhece. Chamada de rotulagem de proximidade, a abordagem atua como tinta spray molecular; quando a galectina-3 se liga a uma proteína, as moléculas geradas por uma galectina-3 derivatizada marcam irreversivelmente as proteínas da área. Então, os cientistas podem trabalhar de trás para frente a partir das partes destacadas da proteína para encontrar o local exato de ligação da galectina-3.
No novo estudo, Huang e colegas usaram marcação de proximidade para mapear a ligação da galectina-3 em células cultivadas em laboratório derivadas de tecido placentário humano. Destacaram-se duas proteínas às quais a galectina-3 se ligou consistentemente: CD9 e integrina beta 1 (ITGB1). Quando os investigadores removeram qualquer uma das proteínas das células da placenta, as células já não se fundiam durante o desenvolvimento da placenta. Então, quando investigaram a quais locais específicos da proteína CD9 a galectina-3 se ligava, a equipe descobriu um local de glicosilação não convencional.
“Foi realmente emocionante encontrar uma sequência de glicosilação tão rara”, diz a primeira autora Abigail Reeves, estudante de pós-graduação da Scripps Research no laboratório de Huang. “Isso realmente ressalta o quão pouco sabemos sobre esse tipo de glicosilação. Não podemos prever com certeza absoluta quais açúcares irão decorar uma proteína e quais proteínas de ligação ao glicano reconhecerão essa modificação.”
A equipe também mostrou que as moléculas de galectina-3 precisam se agrupar para impulsionar a fusão celular. Quando eles projetaram a galectina-3 para ser incapaz de se agrupar, as células da placenta não se fundiram mais.
“Achamos que o que está acontecendo é que a galectina-3 está se ligando a essas glicoproteínas CD9 na superfície celular e unindo-as, criando esta estrutura gigante e rígida”, explica Huang. O processo leva cerca de 48 horas, e o agrupamento da membrana finalmente desencadeia a fusão das células, sugerem os dados.
O novo estudo acrescenta evidências crescentes de que as interações individuais entre proteínas e cadeias de açúcar podem ter grandes efeitos na função celular, acrescenta Huang.
Os investigadores estão agora a trabalhar para confirmar se o processo ocorre no desenvolvimento de placentas humanas, em vez de linhas celulares isoladas. Essa visão poderia eventualmente apontar para novas formas de prevenir complicações na gravidez através da mediação da galectina-3. A equipe também planeja aplicar marcação de proximidade a outros tipos de células para continuar estudando o papel das interações proteína-açúcar na biologia humana.
Mais informações:
Abigail E. Reeves et al, Mapeando o interactoma da galectina-3 placentária identifica CD9 e ITGB1 como contra-receptores funcionais de glicoproteínas durante a sincicialização, Anais da Academia Nacional de Ciências (2025). DOI: 10.1073/pnas.2511042122
Citação: Interações açúcar-proteína, críticas para a placenta durante o início da gravidez, lançam luz sobre complicações comuns (2025, 5 de novembro) recuperado em 5 de novembro de 2025 em
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
Share this content:
Publicar comentário